2024年3月Cell期刊精华
来源:生物谷原创 2024-04-01 14:28
揭示DHX9应激颗粒保护子细胞免受紫外线破坏的RNA的伤害、揭示卵子受精后,ZP2蛋白切割通过调节卵外被的结构来阻止更多精子进入
2024年3月份即将结束,3月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1. Cell:揭示DHX9应激颗粒保护子细胞免受紫外线破坏的RNA的伤害
doi:10.1016/j.cell.2024.02.028
在细胞分裂过程中,新的子细胞会从母细胞那里继承遗传物质和其他分子的混合物。这种遗传既包括有益的成分,可以帮助它们在生命中有一个强健的开端,也包括潜在的有害突变或受损分子,给新生的子细胞带来巨大挑战。
子细胞如何控制和减轻有害遗传的影响一直是个谜。在一项新的研究中,来自德国马克斯-普朗克免疫生物学与表观遗传学研究所的研究人员揭示了一种复杂的机制,通过这种机制,子细胞可以保护自己免受从母细胞遗传而来的受紫外线破坏的RNA的伤害。相关研究结果于2024年3月18日在线发表在Cell期刊上,论文标题为“RNA damage compartmentalization by DHX9 stress granules”。
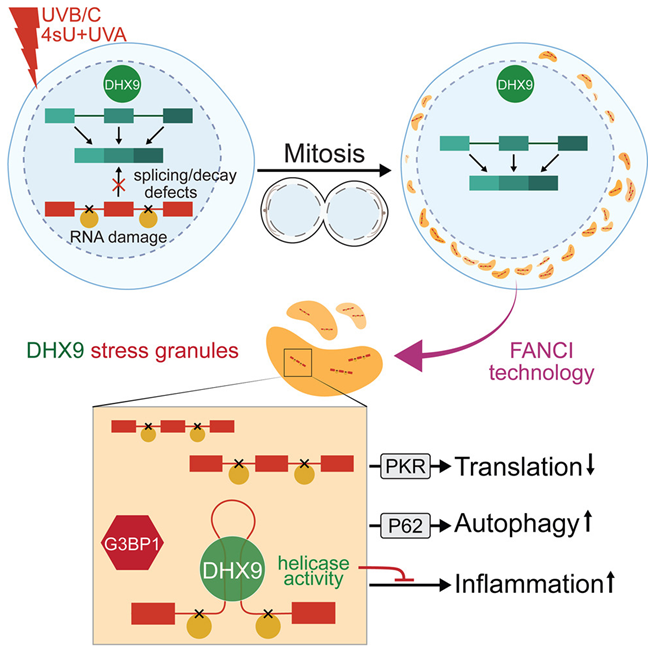
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.028
当太阳光照射到我们的皮肤上时,会给我们带来温暖和活力。然而,在这温柔的怀抱下却隐藏着潜在的威胁:紫外线(UV)照射,阳光中能量最高的成分。虽然我们都知道紫外线会破坏 DNA 并导致皮肤癌,但它对另一种重要分子——RNA的影响却往往不被人注意。
在测试细胞对多种应激源的反应时,这些作者注意到了一些耐人寻味的现象:紫外线照射后,一种名为DHX9的蛋白在细胞质内聚集成液滴结构。众所周知,紫外线辐射会造成 DNA 损伤,因此这些作者最初猜测这些 DHX9 颗粒是防止这种损伤的防御机制。
论文第一作者Yilong Zhou说,“与这一假设相反,我们发现多种形式的DNA损伤刺激并未触发DHX9颗粒。这促使我们去探究真正的触发因素。”因此,他们开发了一种突破性的液滴提取方法,直接从细胞中分离出这些颗粒并分析其含量。令人惊讶的是,他们发现,作为应激颗粒的一种特殊类型,DHX9颗粒中含有受损的RNA。
Akhtar解释说,“紫外线对 RNA 的破坏作用常常被低估,它对DNA的影响也掩盖了这一点。如今,我们发现了一种优雅的机制:细胞可以在DHX9颗粒的帮助下分离和中和受到有害的紫外线破坏的RNA。”
当细胞检测到紫外线照射引起的 RNA 损伤时,它们会迅速将受损分子捕获到 DHX9 颗粒中,从而防止它们造成进一步伤害。这种保护机制有效地限制了损伤,确保它不会在细胞内无节制地扩散,造成进一步的混乱。
2. Cell:揭示卵子受精后,ZP2蛋白切割通过调节卵外被的结构来阻止更多精子进入
doi:10.1016/j.cell.2024.02.013
在一项新的研究中,来自瑞典卡罗林斯卡医学院的研究人员发现卵子被精子受精后,周围的卵外被(egg coat)会收紧,机械地阻止更多精子进入和随后的胚胎死亡。这一发现还解释了卵外被蛋白的突变如何导致女性不孕,并有可能最终开发出新的避孕方法。相关研究结果发表在2024年3月14日的Cell期刊上,论文标题为“ZP2 cleavage blocks polyspermy by modulating the architecture of the egg coat”。
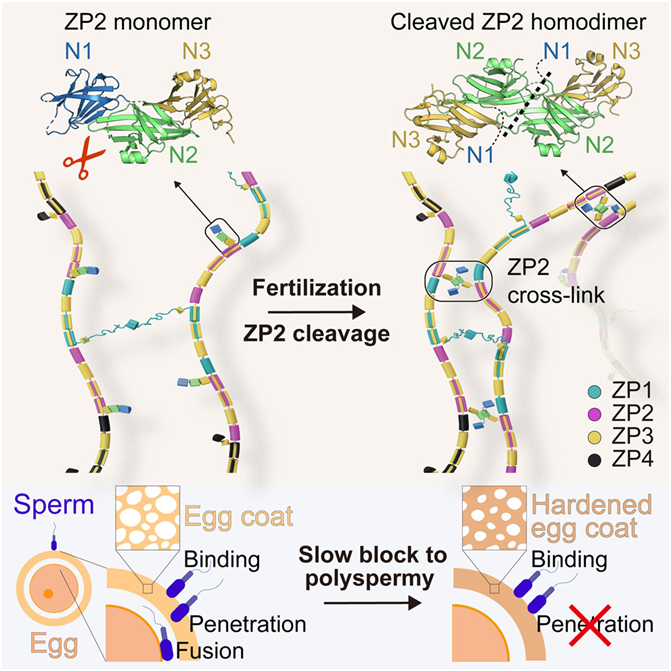
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.013
哺乳动物的受精过程始于精子附着在卵外被上,其中卵外被是一种丝状细胞外包膜,精子必须穿透卵外被才能与卵子融合。如今,这些作者详细绘制了蛋白ZP2的结构和功能图,其中ZP2是卵外被的一个组成部分,在调节受精时卵子和精子如何相互作用方面起着关键作用。
论文通讯作者、卡罗林斯卡医学院生物科学与营养学系教授Luca Jovine说,“众所周知,ZP2 在第一个精子进入卵子后会被裂解,我们解释了这一事件如何使卵外被变得更坚硬,无法被其他精子渗透。这可以防止多精子症(polyspermy)——多个精子与一个卵子融合,这对胚胎来说是致命的。”
doi:10.1016/j.cell.2024.01.036
在一项新的研究中,来自英国约翰内斯中心的研究人员使用了一种名为低温电镜(cryo-EM)的方法来探索光合作用蛋白如何产生,从而在原子水平上发现了光合作用的秘密。他们提供了一种模型和资源,可促进该领域的进一步基础发现,并有助于实现开发抗逆性更强的作物的长期目标。他们的发现为了解十多亿年前让地球绿化的植物超能力提供了重要的新线索。相关研究结果发表在2024年2月29日的Cell期刊上,论文标题为“Structure of the plant plastid-encoded RNA polymerase”。
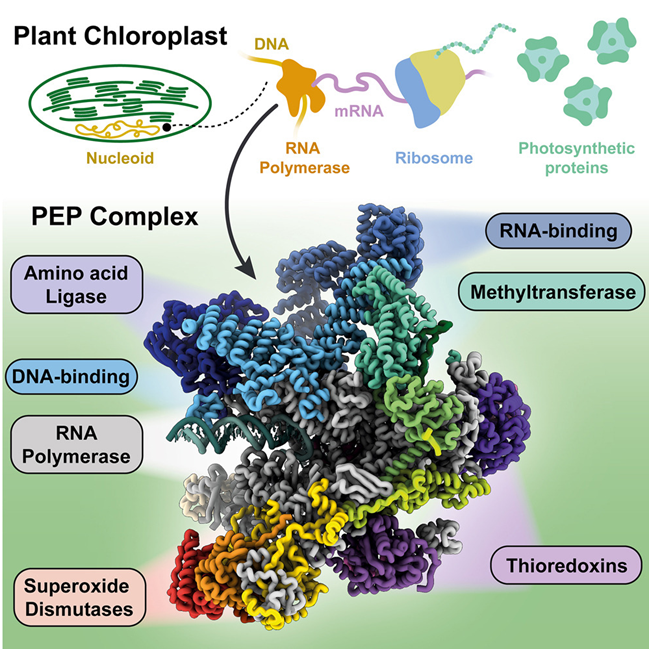
图片来自Cell, 2024, doi:10.1016/j.cell.2024.01.036
Webster团队研究植物如何制造光合蛋白,这些分子机器使这一优雅的化学反应得以实现,将大气中的二氧化碳和水转化为单糖,并产生氧气作为副产物。蛋白生产的第一阶段是转录,通过读取基因产生“信使 RNA(mRNA)”。这一转录过程由一种名为 RNA 聚合酶的酶完成。
50 年前,人们发现叶绿体中含有自己独特的 RNA 聚合酶。从那时起,科学家们就对这种酶的复杂程度感到惊讶。它比它的祖先细菌 RNA 聚合酶有更多的亚基,甚至比人类的 RNA 聚合酶还要大。Webster团队希望了解为什么叶绿体有如此复杂的 RNA 聚合酶。为此,他们需要将叶绿体 RNA 聚合酶的结构构造进行可视化观察。他们使用一种称为低温电镜(cryo-EM)的方法,对从白芥菜植物中纯化的叶绿体 RNA 聚合酶样本进行成像。通过处理这些图像,他们构建了一种包含这种分子复合物中 5 万多个原子位置的模型。这种RNA 聚合酶复合物由细胞核基因组和叶绿体基因组编码的 21 个亚基组成。在转录过程中对这种结构进行仔细分析允许他们能够开始解释这些亚基的功能。
通过这种模型,他们确定了一种蛋白,他能够在 DNA 转录时与它相互作用,并将它引导到这种RNA 聚合酶的活性位点。另一个亚基可以与正在产生的 mRNA 相互作用,从而在 mRNA 转化为蛋白之前保护它使之不被降解。
doi:10.1016/j.cell.2024.02.019
在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员发现了数千种以前未知的胆汁酸,即一类被肠道微生物组用来与身体其他部分沟通的分子。相关研究结果于2024年3月11日在线发表在Cell期刊上,论文标题为“The underappreciated diversity of bile acid modifications”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.019
论文通讯作者、加州大学圣地亚哥分校斯卡格斯药学院教授Pieter Dorrestein博士说,“胆汁酸是肠道微生物组语言的关键组成部分,发现这么多新类型的胆汁酸从根本上扩大了我们的词汇量,让我们了解肠道微生物在做什么以及它们是如何做的。这就像是从‘警犬追杀令(See Spot Run)’到莎士比亚。”
论文共同第一作者、Dorrestein 实验室博士后研究员 Ipsita Mohanty 博士说,“当我开始在实验室开展研究工作时,已知的胆汁酸大约有几百种。如今我们又发现了数千种胆汁酸,而且我们还在努力认识到,这些胆汁酸的作用远不止帮助消化这么简单。”
5. Cell:我国科学家从结构上揭示人类GlyT1的转运机制
doi:10.1016/j.cell.2024.02.026
精神分裂症是一种高度致残性精神障碍。大量研究已表明,N-甲基-d-天冬氨酸(NMDA)受体功能低下是这种疾病的致病机制之一。甘氨酸转运体 1(glycine transporter 1, GlyT1)是一种甘氨酸转运蛋白,与 NMDA 受体高度共定位。抑制 GlyT1 可增加突触间隙中甘氨酸的浓度,从而间接促进 NMDA 受体的激活。因此,GlyT1 被认为是治疗精神分裂症的一个关键靶点。
在一项新的研究中,中国科学院生物物理研究所研究员赵岩(Zhao Yan)教授课题组揭示了全长野生型人类 GlyT1的三种不同构象,从而阐明了底物识别以及三种抗精神分裂症候选药物选择性抑制 GlyT1 的机制。相关研究结果于2024年3月20日在线发表在Cell期刊上,论文标题为“Transport mechanism and pharmacology of the human GlyT1”。
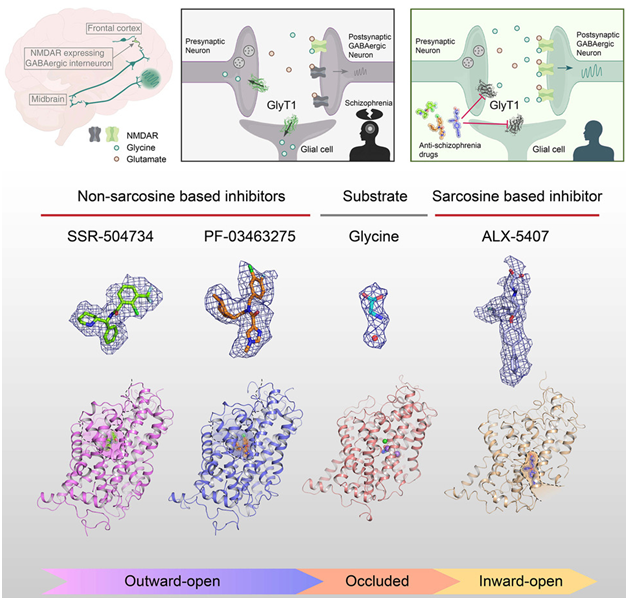
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.026
这些作者报告了甘氨酸在闭锁状态下与 GlyT1 结合在一起时的结构,同时确定了与甘氨酸共同转运的一个氯离子和两个钠离子的结合位点,从而阐明了转运过程中底物和离子结合的耦合机制。
目前,通过靶向GlyT1 治疗精神分裂症的临床候选药物可分为肌氨酸类和非肌氨酸类。这些作者发现,最初的先导氨酸类抑制剂 ALX-5407 与 GlyT1 的一个内向口袋结合。他们还发现首个获得专利的非肌氨酸类抑制剂 SSR504734 和目前处于2期临床试验阶段的药物 PF-03463275 与 GlyT1 的一个外向口袋结合。
6. Cell:新生儿中性粒细胞减少症可能源于胎儿造血干细胞受到抑制
doi:10.1016/j.cell.2024.02.002
与成人相比,新生儿极易受到感染,这些感染可导致严重的健康并发症,甚至死亡。影响新生儿对感染反应的一个已知因素是新生儿中性粒细胞减少症,即婴儿无法制造足够的中性粒细胞,而中性粒细胞是免疫系统的第一反应者。这种免疫缺陷大大增加了新生儿对感染的易感性,但这种缺陷的根本原因目前还不清楚,因此临床医生对如何预防或治疗这种疾病知之甚少。
如今,在一项新的研究中,来自美国哥伦比亚大学的研究人员以小鼠为研究对象,发现许多新生儿中性粒细胞减少症可能源于胎儿造血干细胞受到抑制,这种抑制是一种天然的保护胎盘免受炎症侵袭的母体机制,但如果出生后不关闭,可能会使新生儿易受感染。相关研究结果发表在2024年3月14日的Cell期刊上,论文标题为“Maternal inflammation regulates fetal emergency myelopoiesis”。
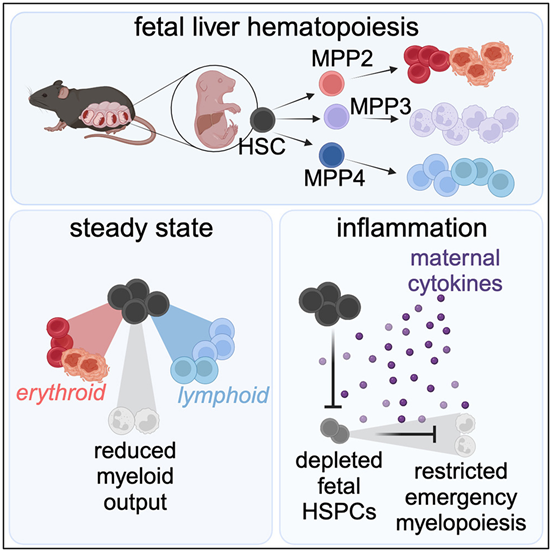
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.002
论文共同通讯作者、哥伦比亚大学瓦格洛斯内外科医学院遗传学与发育教授Emmanuelle Passegué博士说,“关于新生儿中性粒细胞减少症,我们还有很多需要了解的,但这是开发新疗法的令人鼓舞的一步。我们的发现告诉我们,对抗抑制胎儿和新生儿造血干细胞的母体因子,而不是试图直接提高这些细胞的产量,可能更有成效。”
doi:10.1016/j.cell.2024.03.001
在一项新的研究中,来自加拿大卡尔加里大学的研究人员发现,当肺部受到感染时,肺部会直接与大脑进行沟通。他们的研究结果表明,大脑在引发疾病症状方面起着至关重要的作用,这可能会改变我们治疗呼吸道感染和慢性疾病的方式。相关研究结果于2024年3月21日在线发表在Cell期刊上,论文标题为“Biofilm exopolysaccharides alter sensory-neuron-mediated sickness during lung infection”。
论文共同通讯作者、卡尔加里大学卡明医学院临床研究员Bryan Yipp博士说,“肺部利用疼痛通路中的相同传感蛋白和神经元让大脑知道发生了感染。大脑会触发与疾病相关的症状,例如整体感觉不适、疲倦、食欲不振。这一发现表明,我们可能必须在治疗感染的同时治疗神经系统。”
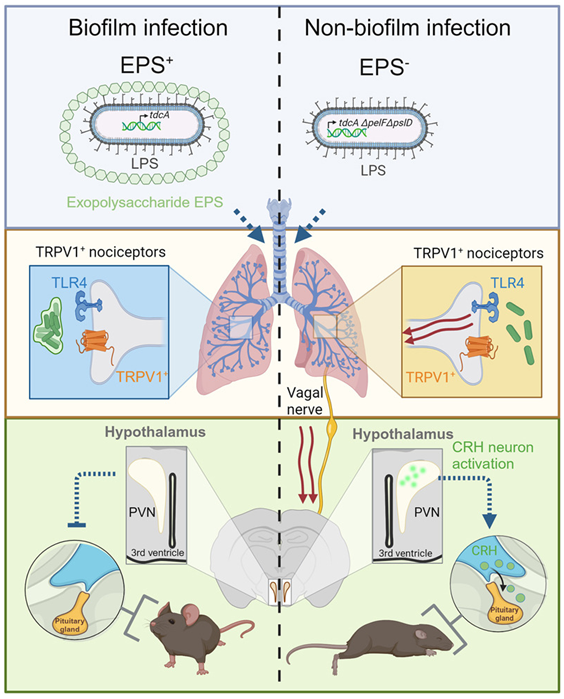
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.001
Yipp说,了解肺-脑通信途径可能对囊性纤维化(CF)等慢性肺部感染患者也有广泛影响。许多囊性纤维化患者的肺部都有生物膜细菌,而且没有症状。他们感觉良好,但病情发作时就会变得很严重。疾病复发的原因并不总是可以追溯的。Yipp说,“病情复发也有可能是神经性的,这些人没有症状是因为细菌藏了起来。”
这些作者补充说,还有一个独特的发现。雄性小鼠的病情比雌性小鼠严重得多,尽管它们感染了同样的细菌。他们发现,雄性小鼠生病比雌性小鼠更依赖于神经元通信。Yipp说,这一发现可能会使所谓的“男性流感(man flu)”变得可信。男性流感是一个口语化的术语,指男性因呼吸道感染而夸大病情。不过,他们可能并没有夸大其词。
8. Cell:重大进展!新研究发现候选药物HRX-215可促进肝脏再生,有望引发急性和慢性肝病治疗变革
doi:10.1016/j.cell.2024.02.023
由德国图宾根大学医院肿瘤内科与肺科医学主任 Lars Zender 教授及其团队领导的一项新研究让人们看到了希望:一种新开发的药物可能预示着肿瘤肝脏手术和肝脏移植的新时代。这种药物甚至有可能显著改善急慢性肝病的治疗。这种称为HRX-215的候选药物是一种所谓的MKK4抑制剂,即给药后能抑制肝细胞中的MKK4蛋白,从而提高肝细胞的再生能力。相关研究结果于2024年3月14日在线发表在Cell期刊上,论文标题为“First-in-class MKK4 inhibitors enhance liver regeneration and prevent liver failure”。
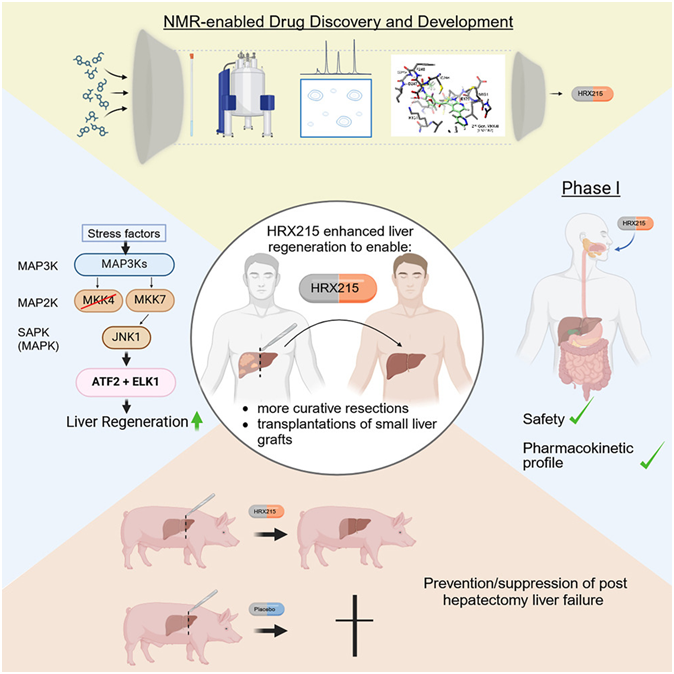
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.023
Zender团队与新创公司 HepaRegeniX 以及美国梅奥诊所的研究人员通力合作,促成了临床前和1期临床研究的成功。针对动物模型的临床前研究表明HRX-215 能促进肝脏再生,从而可以进行以前无法进行的肝脏手术。例如,在晚期肝肿瘤病例中,医生无法切除所有病变组织,因为这样做会导致剩余的肝脏出现功能衰竭。
如今,由于HRX-215具有快速促进肝脏再生的潜力,即使是晚期肝肿瘤患者也可能将它完全切除。此外,这种活性物质还能为更多人提供挽救生命的肝脏移植手术。在 48 名健康志愿者中进行的1期临床研究显示,该药物具有极佳的安全性和耐受性。
9. Cell:意外!某些遗传性眼病中的视力丧失可能是由于肠道细菌进入眼睛引起
doi:10.1016/j.cell.2024.01.040
在一项新的研究中,来自中国中山大学、广州医科大学、南华大学、南方医科大学和英国伦敦大学学院等研究机构的研究人员在小鼠中发现,某些遗传性眼病中的视力丧失可能是由肠道细菌引起的,而且可能可以通过抗菌剂治疗。他们观察到,在因一种特定基因突变(已知该突变可引起导致失明的眼病产生)而导致视力下降的眼睛中,肠道细菌在眼睛的受损区域被发现。相关研究结果于2024年2月26日在线发表在Cell期刊上,论文标题为“CRB1-associated retinal degeneration is dependent on bacterial translocation from the gut”。
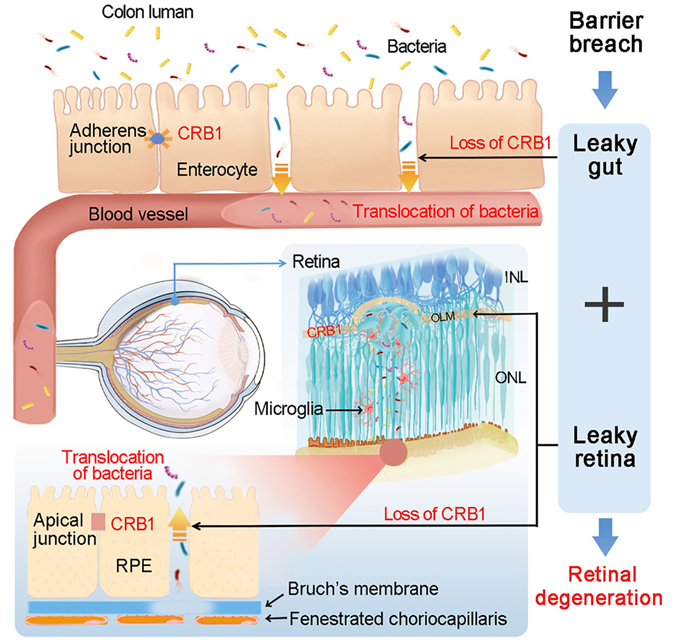
图片来自Cell, 2024, doi:10.1016/j.cell.2024.01.040
这些作者指出,他们的研究结果表明,这种基因突变可能会使身体的免疫防御松懈,从而使有害细菌进入眼睛并导致失明。论文通讯作者为中山大学的Hong Wei、Feng Zhang和Lai Wei,以及来自伦敦大学学院的Richard W.J. Lee。
CRB1基因与遗传性眼病有关,其中最常见的是莱伯先天性黑朦(Leber congenital amaurosis, LCA)和色素性视网膜炎(retinitis pigmentosa, RP);全球10%的LCA病例和7%的RP病例都是由该基因引起的。这些作者利用小鼠模型发现,CRB1 基因是控制下胃肠道完整性的关键,这是首次取得这样的观察结果。在下胃肠道中,它通过调节肠道内含物与身体其他部分之间的物质传递来对抗病原体和有害细菌。
他们发现,当该基因发生一种特殊突变,抑制了它的表达(降低了它的作用)时,视网膜和肠道中的屏障就会受到突破,使肠道中的细菌能够通过身体进入眼睛,从而导致引起视力下降的视网膜病变。最重要的是,用抗菌剂(如抗生素)治疗这些细菌能够防止小鼠视力丧失,尽管这样做并不能重建眼睛中受影响的细胞屏障。
doi:10.1016/j.cell.2024.02.036
本体感觉涉及一个复杂的传感器网络,这些传感器嵌入我们的肌肉中,将有关肢体位置和运动的信息反馈给我们的大脑。然而,人们对大脑如何将从肌肉接收到的不同信号组合在一起却知之甚少。
如今,在一项新的研究中,瑞士洛桑联邦理工学院的Alexander Mathis及其团队通过探索我们的大脑如何创造一种连贯的身体位置和运动感来揭示这个问题。相关研究结果于2024年3月21日在线发表在Cell期刊上,论文标题为“Task-driven neural network models predict neural dynamics of proprioception”。
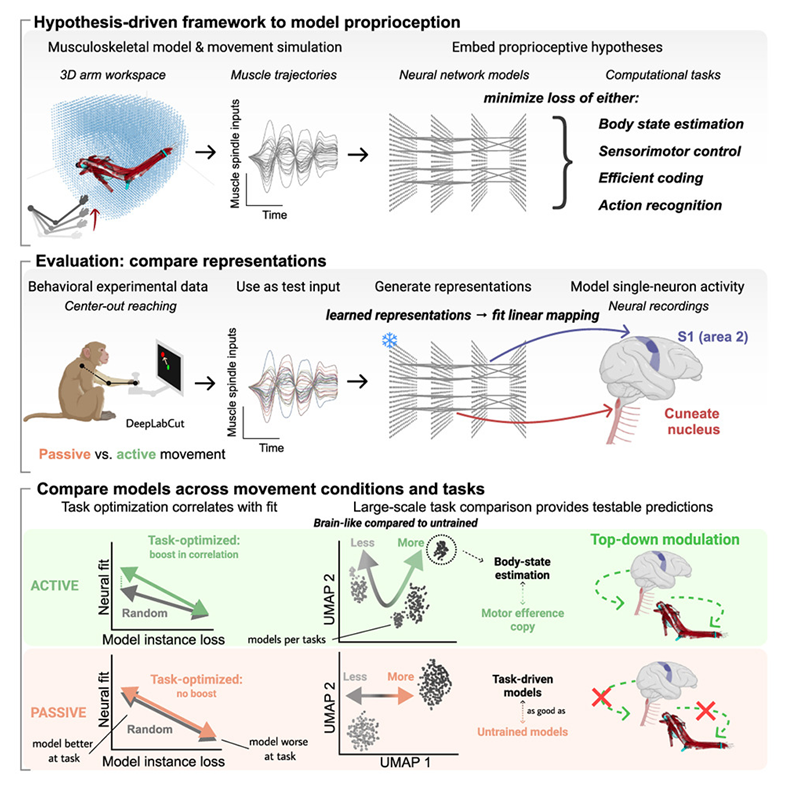
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.036
这些作者利用这种肌肉骨骼建模来产生上肢的肌梭(muscle spindle)信号,从而生成一系列 “大规模、自然的运动清单(large-scale, naturalistic movement repertoire)”。然后,他们利用这些运动清单在 16 项计算任务上训练数千个“任务驱动的”神经网络模型,每项任务都反映了关于本体感觉通路(包括脑干和体感皮层的部分)进行计算的科学假说。
这种方法使得他们能够全面分析不同的神经网络架构和计算任务如何影响本体感觉信息的 “类脑”表征的产生。他们发现,在预测肢体位置和速度的任务中训练出来的神经网络模型最为有效,这表明我们的大脑会优先整合分布式肌梭输入来理解身体运动和位置。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


